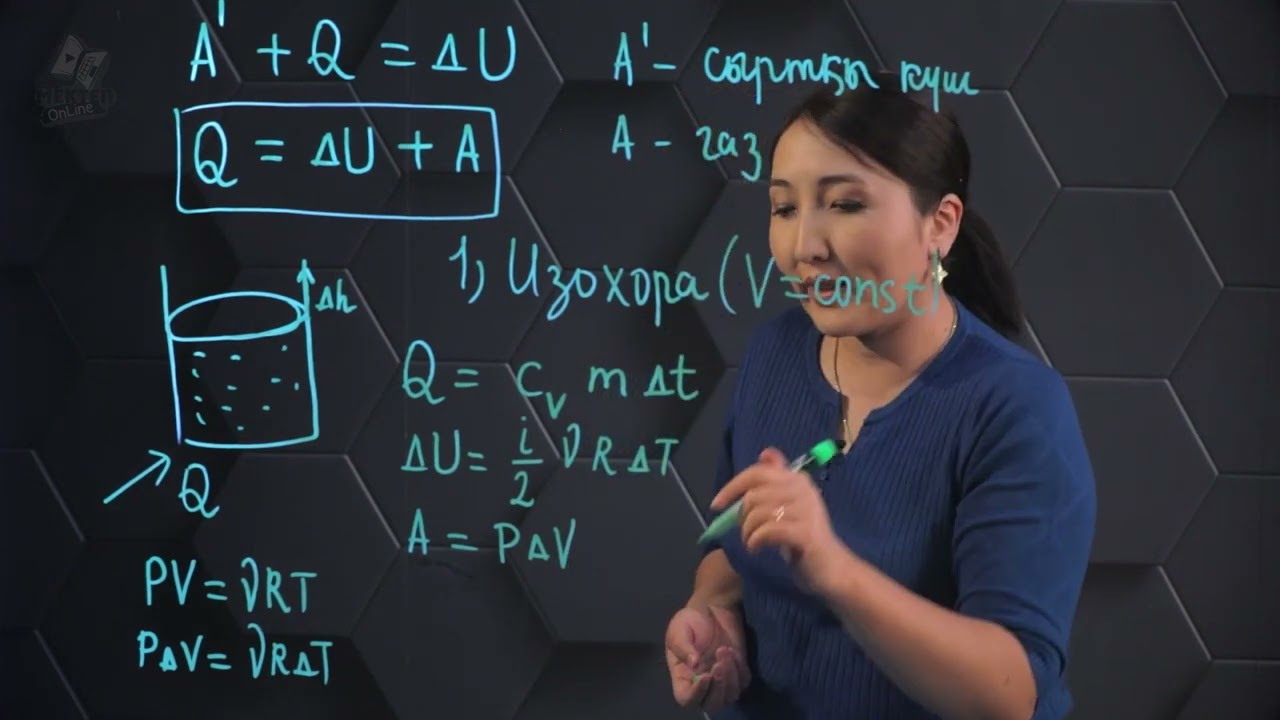Термодинамиканың I заңын изопроцестерге қолдану үшін нақты мысалдар мен есептер арқылы түсіндірілген демонстрация сабағын қарастырайық. Біз изотермиялық, изобариялық және изохорлық процестерді қарастырып, термодинамиканың I заңын әр процесте қалай қолдануға болатынын түсіндіреміз Сабақ: Термодинамиканың I заңын изопроцестерге қолдану
Термодинамиканың бірінші заңы
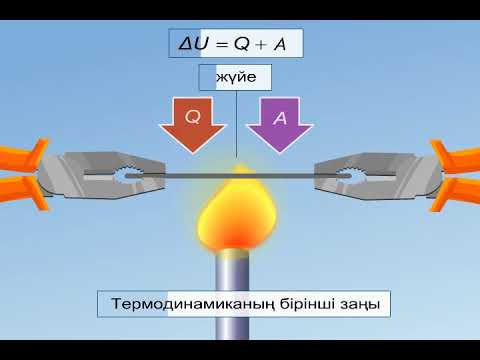
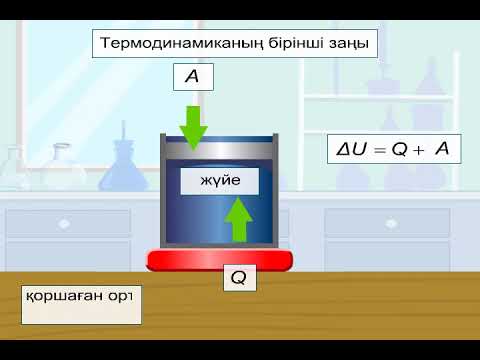
Термодинамиканың бірінші заңы бойынша «Энергияның әртүрлі формалары бір-біріне тек эквивалентті мөлшерде ауысады, яғни энергия пайда болмайды немесе жоғалып кетпейді».
Басқаша сөзбен айтқанда жылу Q және жұмыс A түрінде бөлінетін немесе сіңірілетін энергия кез келген процесс үшін тұрақты болады да, A+Q қосындысы жүйенің ішкі энергиясы деп аталатын, жалпы энергиясына тең болады.

Термодинамиканың бірінші заңын мынандай математикалық теңдікпен көрсетуге болады.
∆ U=A+Q
∆ U - бір күйден екінші күйге ауысқандағы жүйенің ішкі энергиясының өзгеруі. Бұл жерде ішкі энергия өзгерісінің абсолюттік мәнін бағалау мүмкін емес, сондықтан есепке тек ішкі энергия өзгерістерінің айырмашылығы ғана алыныды.
Термодинамиканың бірінші заңын химиялық реакцияларға қалай қолдануға болады?
Химиялық реакция кезінде жүйенің көлемі өзгеріссіз қалатын жағдайлар. Егер реакция кезінде жүйенің көлемі тұрақты болса, онда істелінетін жұмыстың мөлшері нольге тең болады.
Яғни: dv=0
A= - p dv = 0
Сондықтан: ∆ U= Q v
Бұдан шығатын қорытынды көлемі өзгеріссіз қалатын реакцияларда, реакция жүрген кездегі жұмсалатын жылудың мөлшері жүйенің ішкі энергиясын өзгертуге ғана жұмсалады:
Q v = U 2 -U 1 = ∆ U
Сонымен, химиялық реакция кезінде, оның көлемі тұрақты болса, бөлінетін немесе сіңірілетін жылудың мөлшері жүйенің ішкі энергиясының өзгеруіне байланысты болады.
Қысым тұрақты болғанда жүретін процестер. Энтальпия. Атмосфералық қысымда жүретін реакцияны, тұрақты қысымда жүретін реакцияның мысалы ретінде қарастырып өтейік.
Жүйенің алғашқы күйі: массасы- m 1 ; қысымы- p; температура- T 1 ; көлемі- V 1
Жүйенің соңғы күйі, яғни жабық ыдыстағы 2-ші күйі, бұл жағдайда температура T 2 көлем V 2 болып өзгерді. Ішкі энергияның өзгерісін математика тілімен:
∆ U=U 2 -U 1 =A+Q p
деп көрсетуге болады.
Q p - тұрақты қысым болғанда жұмсалатын жылу, жүйенің ішкі энергиясын өзгертуге және сыртқы қысымға қарсы жұмыс жасауға жұмсалады.
Мұндай өзгерістер кезінде:
A= - p (V 2 -V 1 )
U 2 - U 1 = Q p - p (V 2 -V 1 )
Q p = U 2 - U 1 + p (V 2 -V 1 )
Q p =(U 2 + p V 2 ) - (U 1 + p V 1 )
H=U+pV деп белгілеп, теңдеуді мына түрде жазуға болады:
Q p = H 2 - H 1 = ∆ H
∆ H - жүйенің энтальпиясы деп аталады, яғни энтальпия - көлемі ұлғайғандағы жүйенің энергиясы. Жоғарыда айтқандай ішкі энергияның U абсолюттік мәнін өлшеуге болмайтыны сияқты, энтальпияның да абсолюттік мәнін өлшеуге болмайды. Сондықтан жүйе бір күйден екінші күйге көшкенде өзгеретін энтальпияны ∆ H өлшейді. Энтальпияның мәнін килоджоульмен (кДж) немесе килокалориямен (кКал) көрсетеді.
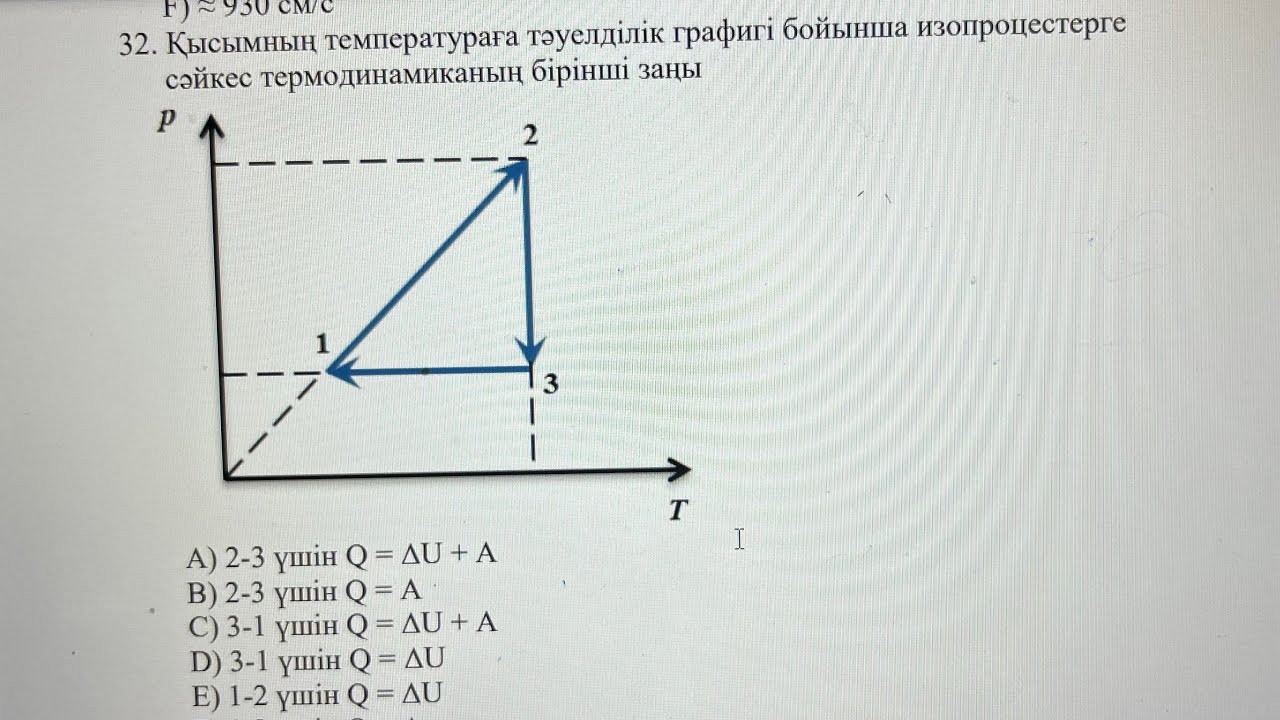
Жарайды.Изобаралық изохоралық изотермиялық процестерді графиктерде көрсетейік.
Термодинамиканың I заңын изопроцестерде қолдануға қандай тәжірибиелер көрсетуге болады
Йя өте керемет пайдалы сабағымызға пайдасы тиді
Керемет іске сәт сабаққа қолайлы екен
Өте керемет түсіндірілген.Сабаққа түсіндіруге тиімді екен
Құнды бейне сабақтар екен
Берілген видео материалдар жақсы түсіндірілген екен.Сабақта пайдаланылған тиімді екен
Керемет сабағыма пайдасы тиеді
Күшті жаксы мәліметтер беріліпті
Сабақ өте керемет.Құнды дүниелер айтылған
Күшті екен. Өзіме керек материалдарды алдым
Сабақ күшти жасалған. Өзиме күшти материалдар алдым